![]() Биологически активные продукты пчеловодства (БАПП) в настоящее время применяют в качестве ингредиентов биологически активных добавок (БАД). Их безопасность следует не только строго контролировать, но желательно, и прогнозировать.
Биологически активные продукты пчеловодства (БАПП) в настоящее время применяют в качестве ингредиентов биологически активных добавок (БАД). Их безопасность следует не только строго контролировать, но желательно, и прогнозировать.
Известно, что пчелиная обножка — продукт смешанного происхождения, она присутствует в составе меда и прополиса, является основой перги и представляет собой БАД. Присутствие различных поллютантов в перечисленных БАПП в большой степени определяется наличием в них пыльцы. Поэтому естественный уровень микробной обсемененности пыльцевой обножки служит отправной точкой в оценке микробиологической безопасности продуктов пчеловодства.
Существует проблема несоответствия партий обножки из различных регионов России требованиям СанПиН 2.3.2.1078—01 по микробиологическим показателям, что не всегда связано с соблюдением технологии сбора, транспортировки и хранения этого продукта. Вероятно, что это несоответствие возникает из-за состава эпифитной микрофлоры обножки.
Мы изучали эпифитную микрофлору пыльцевой обножки медоносных пчел, собранной в июне 2002, 2003, 2004 гг. на пасеках в различных природно-климатических зонах Новосибирской и Кемеровской областей, а также Алтайского края. Образцы обрабатывали с соблюдением технологических требований. Оценивали микробиологические показатели, регламентируемые СанПиН 2.3.2.1078—01, с помощью методов, установленных соответствующими ГОСТами, в лицензируемой микробиологической лаборатории СибНИПТИП СО РАСХН. Монофлерные образцы получали механическим делением полифлерных в ходе ольфакторного и палинологического анализов. Экспериментальные данные исследовали с использованием пакета прикладных программ Snedekor V4 методами вариационного, дисперсионного, корреляционного анализов, определения популяций по Животовскому.
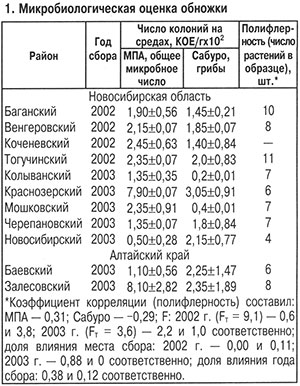 Обножка, собранная в 2002 и 2003 гг., по общей микробной обсемененности отвечала нормативным требованиям, по загрязненности плесневыми грибами им соответствовали только 16,7% образцов (табл. 1). Большинство характеризовалось превышением норматива (не более 100 КОЕ/г) в 1,4–3,3 раза. В составе микофлоры доминировали виды родов Muсor и Penicillium. Частота встречаемости по вариантам для этих групп составляла 100%, для видов родов Sporotrichum, Aureobasidium и Stemphylium — 60, 20 и 20% соответственно.
Обножка, собранная в 2002 и 2003 гг., по общей микробной обсемененности отвечала нормативным требованиям, по загрязненности плесневыми грибами им соответствовали только 16,7% образцов (табл. 1). Большинство характеризовалось превышением норматива (не более 100 КОЕ/г) в 1,4–3,3 раза. В составе микофлоры доминировали виды родов Muсor и Penicillium. Частота встречаемости по вариантам для этих групп составляла 100%, для видов родов Sporotrichum, Aureobasidium и Stemphylium — 60, 20 и 20% соответственно.
Достоверное влияние района сбора (F>Fт) на микробную обсемененность обножки выявлено в 2003 г., когда изменения этого показателя достигли 88%. Год сбора незначительно влиял как на общую, так и на грибную микрофлору обножки (38 и 12% соответственно).
Слабая корреляция количественных показателей эпифитной микрофлоры с полифлерностью обножки (r=0,31) не позволяет судить о существенной роли ботанического происхождения в ее формировании. Прослеживалась тенденция к снижению количества микромицетов с возрастанием видового разнообразия обножек в образце (r=–0,29).
Эпифитная микофлора обножки в 2004 г. ни по количественному, ни по качественному составу не зависела от района сбора. Максимально (20%) этот фактор воздействовал на количество микромицетов, но несущественно (F<Fт). Таким образом, только в один год из трех было выявлено достоверное влияние района сбора обножки на ее общую микробную обсемененность.
Санитарно-гигиеническая оценка обножки показала, что КМАФАнМ изменялся в зависимости от районам сбора от (5,7±2,5)х102 до (2,7±0,7)х103 КОЕ/г. Это на 1–2 порядка ниже установленного стандартом уровня (1х104 КОЕ/г). Количество спор Bacillus cereus не превышало норматив (При сравнении средних показателей количества микромицетов, выделенных из обножки в 2004 г., установлено достоверное увеличение в образце из Новосибирского района по сравнению с показателями образцов из Мошковского, Залесовского и Мундыбашевского районов (P=0,99), а также из Коченевского (P=0,95).
Анализ популяций микромицетов обножки показал их количественную и качественную разнородность. Критерий идентичности при попарном сравнении колебался от 37 до 79 (c21%=23,2), а показатель общего сходства составил 1,56±0,05. Общее количество микромицетов в составе эпифитной микрофлоры обножки возрастало за счет редких видов грибов (r=0,83; P=0,95), но слабо коррелировало с их видовым разнообразием (r=–0,06).
В образцах из всех районов были представлены виды родов Penicillium и Alternaria. Частота встречаемости в составе эпифитной микрофлоры обножки видов рода Mucor составила 87,5%, Auerobasidium — 50, Aspergillus, Absidia, Trichoderma — по 25, Candida —12,5%. Всего из обножки сбора 2004 г. в среднем по районам выделено 95 штаммов микромицетов, принадлежащих к 11 родам.
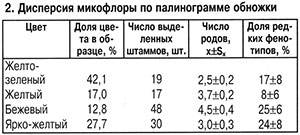 Микологический анализ обножек разного ботанического происхождения в полифлерном образце из одного района подтвердил неодинаковое представительство микромицетов (табл. 2).
Микологический анализ обножек разного ботанического происхождения в полифлерном образце из одного района подтвердил неодинаковое представительство микромицетов (табл. 2).
Максимальное видовое разнообразие с наибольшей долей редко встречающихся видов отличало обножку бежевого цвета. Общее сходство микофлоры обножек разного ботанического происхождения было меньше (1,29±0,08), чем у полифлерной из разных районов. Это связано с тем, что видовой состав микофлоры обножек двух разных видов (желтой и ярко-желтой) был однотипным, критерий идентичности — 8,0 (c21%=18,5).
Независимо от района сбора значительная доля образцов обножки характеризовалась повышенной по сравнению с установленными требованиями обсемененностью грибной микрофлорой. Видовое разнообразие микромицетов специфично для каждого района и зависит от ботанического происхождения обножки.
Свои дальнейшие исследования мы предполагаем направить на оценку безопасности выявленных штаммов и изучение факторов формирования эпифитной микрофлоры обножки. Но уже сейчас следует признать, что разработка показателей безопасности обножки с учетом естественного уровня микробной обсемененности, на необходимость которой указывал Р.Г.Хисматуллин с соавторами (ж-л «Пчеловодство», №7, 2004), — первоочередная задача в области стандартизации этого продукта.
Л.А.ОСИНЦЕВА, К.Я.МОТОВИЛОВ, Г.П.ЧЕКРЫГА, О.В.СОЛОВЬЕВА
Новосибирский государственный аграрный университет, СибНИПТИП СО РАСХ

Улей-лежак на теплый занос…
нояб 8, 2022
Особенности содержания пчелиных семей на…
июнь 28, 2023
Откуда берутся весной слабые семьи?…
апр 20, 2020
Помесные пчелы — надолго или навсегда?…
апр 5, 2017
Ловите рои
июнь 4, 2016
Программируемые медосборы и полифункцион…
март 19, 2015
Фиксирование бесфальцевых корпусов…
март 4, 2018
Мед и сердечно-сосудистые заболевания…
сен 29, 2014
Гемограммы гемолимфы пчел из разных прир…
фев 19, 2024
Подкормка — это просто (2)…
сен 9, 2019
Столик-отстойник
мая 27, 2015
Нам необходим дух улья…
июль 27, 2014
Оплата труда в пчеловодстве…
июнь 5, 2014
Бортники — кто они?
сен 17, 2022
Золотарник – растение, интересное для пч…
июль 7, 2016













 Адрес редакции журнала "Пчеловодство":
Адрес редакции журнала "Пчеловодство":