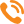УДК 638.154.3
При обследовании пасек в Московской области нами был обнаружен американский гнилец (АГ/AFB — American foulbrood) — инфекционная болезнь личиночной стадии медоносной пчелы Apis mellifera. Возбудитель болезни — грамположительная бактерия Paenibacillus larvae larvae, которая может продуцировать свыше 1 млн спор на 1 личинку Apis mеllifera, погибшую от американского гнильца.
Бактерия выглядит прямой или иногда изогнутой палочкой с закругленными концами (рис. 1). Ее размеры значительно варьируют (при ширине 0,5 мкм длина палочки может составлять от 1,5 до 6 мкм). Бактерии встречаются либо в единичном виде, либо в виде цепочек или нитей. Некоторые штаммы обладают подвижностью. К инициированию болезни способны только споры.
 Здоровые личинки могут быть инфицированы либо спорами от инфицированных пчел-кормилиц, либо спорами, оставшимися на стенках зараженных расплодных ячеек. Хотя к заражению восприимчивы личиночные стадии всех категорий (маток, трутней, рабочих особей), но личинки или предкуколки и куколки трутней наименее восприимчивы, а стадии развития рабочих пчел наиболее восприимчивы и больше склонны к неблагоприятному течению болезни.
Здоровые личинки могут быть инфицированы либо спорами от инфицированных пчел-кормилиц, либо спорами, оставшимися на стенках зараженных расплодных ячеек. Хотя к заражению восприимчивы личиночные стадии всех категорий (маток, трутней, рабочих особей), но личинки или предкуколки и куколки трутней наименее восприимчивы, а стадии развития рабочих пчел наиболее восприимчивы и больше склонны к неблагоприятному течению болезни.
Восприимчивость личинок к американскому гнильцу уменьшается вместе с возрастом: личинки пчел старше 53 ч после выхода из яйца не способны к заражению. Контаминированный спорами Paenibacillus larvae larvae пчелиный воск, используемый для производства вощины, также может способствовать распространению болезни на значительные расстояния. Поэтому раннее диагностирование американского гнильца помогает предотвратить дальнейшее распространение болезни.
Споры Paenibacillus larvae larvae могут выживать в продуктах пчеловодства (меде, воске), сухих чешуйках (корочках) и окружающей среде (почве, воде) от 3 до 10 лет. Сухие свободные споры при хранении вне доступа солнечного света могут жить более 70 лет.
Клинические признаки американского гнильца отличаются значительным разнообразием и зависят от вирулентности штамма Paenibacillus larvae larvae, генотипа личинок, подвергшихся инфекции (определяется принадлежность к стазе: трутень, матка или рабочая пчела), стадии течения болезни пораженной особи и силы пораженной пчелиной семьи (и, возможно, от уровня врожденной резистентности популяции пчел к американскому гнильцу). Пораженные личинки погибают в таком раннем возрасте, когда еще лежат на дне ячеек в виде колечка.
Внешние признаки американского гнильца обнаруживают при осмотре пчелиных семей. В начале болезни наблюдается поражение одиночных личинок (рис.).
Со временем число пораженных личинок увеличивается и можно наблюдать пестрый расплод — на сотах встречаются пустые ячейки (рис.). Разлагающиеся трупы личинок приобретают вязкую консистенцию кофейного цвета, имеют запах столярного клея и вытягиваются палочкой в виде нити.
Таким образом, первоначальный диагноз можно поставить на основании клинических признаков. Для точного диагноза необходимо подтверждение лабораторным исследованием.
Для лабораторного анализа мы готовили водную взвесь, содержащую споры Paenibacilus larvae larvae, и прогревали при 95…96°С в течение 3–5 мин, чтобы убить любые другие спорообразующие патогенные микроорганизмы. Для успешного лабораторного диагноза необходимо учитывать следующее:
⇒ работать только с пчелиной семьей или пасекой, пораженной американским гнильцом или подозреваемой в заражении этим заболеванием;
⇒ анализировать уже существующий очаг болезни на пасеке или стремиться предотвращать появление ее очага на пасеке.
Для диагностики мы применяли следующие методы: микроскопию, полимеразную цепную реакцию (ПЦР), биохимическое исследование.
Микробиологические методы идентификации требуют предварительного культивирования и выделения чистой культуры возбудителя; биологические методы можно использовать прямо на собранных образцах патологического материала. Пробы на основе личинок (предкуколок, куколок) с клиническими признаками болезни приводят к сплошному росту бактериальных колоний по всей поверхности агара в чашке Петри. Это вызывает необходимость дополнительного этапа пересева культуры в другие чашки Петри, чтобы получить изолированные колонии.
Существует две методики проведения ПЦР. Первую можно использовать для быстрого подтверждения диагноза поражения американским гнильцом, поставленного на основе учета наблюдаемых клинических признаков, и для определения видовой принадлежности бактериальных колоний, выросших после предварительного этапа культивирования.
Вторая методика основана на гнездовой (вложенной) ПЦР. Она позволяет не только реализовать две вышеуказанные цели, но и осуществлять непосредственный анализ генома спор. Важно различать клеточно-споровые суспензии и суспензии, содержащие только споры. Последние требуют более сложного этапа экстракции ДНК из споровых суспензий (он не касается вложенной ПЦР).
Если ПЦР нацелена на идентификацию бактериальных колоний (клеточно-споровая суспензия) после этапа культивирования, предварительную обработку осуществляют следующим образом: одну колонию бактерий суспендируют в 50 мл дистиллированной воды и нагревают при 95°С в течение 15 мин.
После центрифугирования при 5000 об./мин в течение 5 мин 1–5 микролитра (мкл) супернатанта используют в качестве матрицы ДНК в 50 мкл смеси для проведения ПЦР. Эти реакции ставят на ПЦР-плашках, где в каждой лунке находится реакционная смесь объемом 50 мкл, содержащая 5 мкл ДНК-матрицы, 50 пикомоль прямого праймера (AFB-F), 10 наномоль каждого трифосфата дезокси-нуклеозида и 1-2,5 ЕД Таg-полимеразы в соответствующем ПЦР-буфере, содержащем 2 миллимоль MgCl2.
При обнаружении американского гнильца на пасеку и территорию в радиусе 5–7 км накладывают карантин. Больные пчелиные семьи перегоняют в новые или продезинфицированные ульи и подкармливают лечебным сиропом.
Одновременно дезинфицируют освободившиеся ульи, соты и рабочий инвентарь. Для этого ульи, рамки и прочие деревянные предметы механически очищают и обрабатывают следующими дезинфицирующими средствами: раствором, содержащим 10% перекиси водорода и 3% муравьиной или уксусной кислоты, из расчета 1 л на один 12-рамочный улей. Дезинфекцию проводят трехкратно с интервалом в 1 ч. Через 1 ч после третьей обработки ульи промывают водой, высушивают и используют по назначению.
Соты после механической очистки омывают раствором, содержащим 3% перекиси водорода и 3% муравьиной или уксусной кислоты, и выдерживают их в этом растворе 1 сут. Затем соты тщательно промывают водой и устанавливают в семьи. Воск, предназначенный для изготовления вощины, обеззараживают в автоклаве в течение 2 ч. Мерву сжигают. Ульевые холстики и мелкий пчеловодный инвентарь кипятят в 3%-ном растворе кальцинированной соды в течение 30 мин. Медогонки дезинфицируют раствором, содержащим 5% формальдегида и 5% гидроксида натрия, при экспозиции 5 ч. Расход раствора — 1 л/м2. Пчелиный подмор и ульевой мусор сжигают.
Для лечения пчелиных семей применяют препарат оксивит, выпускаемый в виде полосок картона или порошка.
Перед применением оксивита рамки с сильно пораженным расплодом удаляют, больные семьи перемещают в чистые продезинфицированные ульи. Гнезда больных семей сокращают и утепляют, обеспечивают пчел доброкачественным кормом, по возможности заменяют маток здоровыми плодными.
Полоски оксивита подвешивают вертикально между рамками в середине гнезда и оставляют в семьях на срок от 6 до 7 сут или до их полного разрушения пчелами.
Порошок оксивита применяют в дозе 0,5 г на одну семью силой 10 улочек тремя способами: опрыскиванием, опудриванием, скармливанием с сахарным сиропом или медово-сахарным тестом (канди).
Опрыскивание проводят лечебным раствором. Для его приготовления количество препарата, рассчитанное на число обрабатываемых семей, сначала размешивают в небольшом объеме кипяченой (35…40°С) воды, затем вносят в теплый (35…40°С) водный раствор сахара (1 : 4). Сотовые рамки с пчелами опрыскивают из мелкодисперсного опрыскивателя, обеспечивающего их равномерное смачивание (норма расхода — 10–15 мл лечебного раствора на одну рамку), особенно тщательно обрабатывая зоны размещения пораженного расплода.
Опудривание проводят лечебным составом. Для его приготовления количество препарата, рассчитанное на число обрабатываемых семей, смешивают с сахарной пудрой (5–6 г на одну рамку).
Для скармливания пчелам необходимое количество препарата сначала размешивают в небольшом количестве теплой воды, затем добавляют к сахарному сиропу (1 : 1) и дают семьям из расчета 100 мл на одну рамку. В канди порошок вносят из расчета 5 г на 10 кг медово-сахарного теста и дают пчелам по 0,5 кг на одну семью.
Лечебные обработки проводят 3–4 раза с интервалом в 6–7 дней до исчезновения клинических признаков заболевания.
Р.Т.КЛОЧКО, С.Н.ЛУГАНСКИЙ, А.В.БЛИНОВ
ВНИИ ветеринарной санитарии,
гигиены и экологии —
филиал ФГБНУ «ФНЦ ВИЭВ РАН»
Американский гнилец — инфекционная болезнь печатного пчелиного расплода, вызываемая спорообразующим микроорганизмом Paenibacillus larvae larvae. Проявляется летом, реже весной. Больные личинки погибают в запечатанных ячейках сотов, превращаются в тягучую, гнилостную массу кофейного цвета с запахом столярного клея, при высыхании трудно отделимы от стенок ячеек. Явной форме болезни предшествует накопление спор возбудителя в семье (соты, корма) за прошлые годы. Диагностируют американский гнилец на основании обнаружения возбудителя, при наличии характерных признаков поражения расплода, с учетом эпизоотической ситуации. Карантин с пасеки снимают через год после ликвидации заболевания при отрицательных результатах исследований всех пчелиных семей в карантинной зоне.
Ключевые слова: американский гнилец, Apis mellifera, пестрый расплод, дезинфекция, лечение пчел, оксивит.
ЛИТЕРАТУРА
1. Гробов О.Ф., Смирнов А.М., Попов Е.Т. Болезни и вредители медоносных пчел. — М., 1987.
2. Hansen Н., Brodsgaard C.J. American foulbrood: a review of its biology, diagnosis and control // Bee World. — 1999. — V.80.
3. Haseman L. How long can spores of American foulbrood live? // Am. Bee J. — 1961. — V.101.
4. Holst E.C. A simple field test for American foulbrood //Am. Bee J. — 1946. — V.86.
5. Lindstrцm A., Korpela S., Fries I. Horizontal transmission of Paenibacillus larvae spores between honey bee (Apis mellifera) colonies through robbing // Apidologie. — 2008. — V.39.
6. Shimanuki H. Honey Bee Pests, Predators and Diseases. — The A.I. Root Company, Medina, Ohio, USA, 1997.
7. Shimanuki H., Knox D.A. Improved method for the detection of Bacillus larvae spores in honey // Am. Bee. J. — 1988. — V.28.
8. Toshkov A., Valarianov T., Tomov A. The immunofluorescence method and the quick and specific diagnosis of American foulbrood of beebrood // Bull Apic. — 1970. — V.13.
СВЕДЕНИЯ ОБ АВТОРАХ:
Клочко Раиса Тимофеевна, канд. биол. наук, e-mail:
Луганский Сергей Николаевич, канд. биол. наук, e-mail:
Блинов Алексей Валерьевич, канд. вет. наук, e-mail:
VETERINARY AND SANITARY MEASURES
AT AMERICAN FOULBROOD OF BEES
R.T.Klochko, S.N.Lugansky, A.V.Blinov
American foulbrood is an infectious disease of the sealed bee brood caused by the spore-forming microorganism Paenibacillus larvae (Bacillus larvae). It appears in the summer, less often in the spring. Infected larvae die in sealed honeycomb cells, turning into a viscous, putrid mass of coffee color with the odor of wood glue. Dead infected larvae are difficult to separate from the honeycomb cell walls aftеr drying. Clear sight of the disease is preceded by accumulation of pathogenic spores (in honeycombs, bee food) in the honeybee colony in past years. The diagnosis is based on: the fact of detection of the pathogen, characteristic signs of brood damage, and the epizootic situation. Quarantine with apiaries is raised a year after the detection of diseases, negative research results in all honeybee colonies in the quarantine zone on the American foulbrood.
Keywords: American foulbrood, Apis mellifera, spotted brood, disinfection, honeybees treatment, оksivit.

Новая жизнь старого лекарства…
нояб 30, 2014
Конопидоз в Киргизии
апр 22, 2015
Возрастные изменения физиологического со…
дек 3, 2016
Моя подсадка маток
апр 7, 2015
Некоторые советы по содержанию пчел в ул…
авг 6, 2016
Снова о рамках (2)
янв 4, 2015
Ураган на пасеке
апр 11, 2015
Пчелы живут на 8-м этаже больницы…
авг 14, 2015
Методика хронобиологического анализа мед…
авг 7, 2014
История НИИ пчеловодства. М.В.ЖЕРЕБКИН…
фев 20, 2017
Национальный стандарт на пчелиную матку…
июль 2, 2014
Мнение о существующих ульях…
сен 12, 2022
Пчеловодное воровство…
апр 22, 2014
Шмели учатся у пчел
нояб 21, 2017
Минеральный состав гемолимфы расплода пр…
апр 20, 2022












 Адрес редакции журнала "Пчеловодство":
Адрес редакции журнала "Пчеловодство":