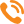Нозематоз — инвазионное заболевание взрослых пчел, маток и трутней, вызываемое микроспоридией рода Nosema, паразитирующей в эпителиальных клетках средней кишки. Заболевание проявляется, как правило, по окончании зимы и весной, характеризуется ослаблением и гибелью семей пчел, маток.
В настоящее время во многих странах мира отмечается нарастание гибели пчел от нозематоза. Сейчас выделено два возбудителя — это давно известная Nosema apis Zander (1909) и сравнительно недавно изученная Nosema ceranae (1996). При использовании обычной световой микроскопии оба возбудителя нельзя отличить друг от друга. Диагностика возбудителя Nosema ceranae в настоящее время возможна только с помощью реакции цепной полимеризации (ПЦР), поэтому с высокой степенью достоверности можно говорить о смешанном микроспоридиозе у европейской пчелы.
Основной источник заражения пчел нозематозом — кал, выделяемый больными пчелами, содержащий ее споры. В средней кишке одной пчелы находится 250–262 млн спор, в прямой кишке — 492 млн спор (О.Ф.Гробов, 1992). Каловые массы загрязняют соты, корм, стенки и дно улья, холстики, кормушки. Поэтому вторичный источник инфекции — контаминированные возбудителем соты, запасы меда и пыльцы, стенки улья, поилки с водой, почва. Сот, изъятый из сильно пораженной нозематозом семьи, содержит 2,6 млн спор (В.Штехе, 1977). Опыты Л.Бейли (1977) показали, что после замены сотов, имеющих следы поноса, в начале летнего сезона происходило резкое сокращение интенсивности заболевания по сравнению с семьями, у которых эту замену не проводили.
При лечении этого заболевания особую актуальность приобретает дезинфекция.
Дезинфицируют при нозематозе пустые сотовые рамки (свободные от меда и перги), пустые ульи, медогонки, емкости для меда, мелкий пчеловодный инвентарь (стамески, клеточки маточные, колпачки и др.). Единственный достоверный критерий оценки качества выполненной работы — биопроба. Для этого с поверхностей, обработанных различными дезинфектантами, делают смывы, из них выделяют споры ноземы, которые затем скармливают вместе с сахарным сиропом молодым пчелам одного—трехдневного возраста, инкубированным в термостате. Учет заражения проводят через 5–7 дней. Для этого у насекомых, предварительно убитых эфиром или замороженных, извлекают среднюю кишку, добавляют дистиллированную воду и тщательно растирают пестиком в фарфоровой ступке. Каплю полученной взвеси просматривают под микроскопом при увеличении в 400 раз. Дезинфекцию считают эффективной, если в поле зрения микроскопа находится не более 1–3 спор ноземы. Биопроба сопровождают контролем.
Недостатки этого метода: трудоемкость, длительность проведения, негуманное отношение к пчелам. В связи с этим сотрудниками лаборатории ветеринарной санитарии в пчеловодстве ВНИИВСГЭ совместно с ООО «Лаборатория Амфора» разработан метод определения жизнеспособности спор микроспоридий рода Nosema методом лазерной интерференционной микроскопии. Его сущность заключается в установлении различия фазовых портретов живых и убитых спор ноземы. На рисунке 1 показано трехмерное изображение фазового портрета спор ноземы.
Живые споры выделяли из средней кишки зараженных нозематозом пчел. Эту суспензию наносили на поверхности тест-объектов, которые затем подвергали дезинфекции: ♦ парами уксусной кислоты 80%-ной концентрации (экспозиция 14 дней); ♦ 10%-ным раствором перекиси водорода (экспозиция 3 ч); ♦ текущим паром при t ~ 100°C (экспозиция 30 мин). Гибель спор ноземы устанавливали методом биопробы.
 Исследование спор проводили на модуляционном интерференционном микроскопе МИМ 2.1 производства ООО «Лаборатория Амфора». Следует отметить, что лазер оказывает слабое влияние на споры и не вызывает изменение их морфологии.
Исследование спор проводили на модуляционном интерференционном микроскопе МИМ 2.1 производства ООО «Лаборатория Амфора». Следует отметить, что лазер оказывает слабое влияние на споры и не вызывает изменение их морфологии.
Наиболее значимые параметры при измерении морфологии живых и мертвых спор — их фазовая толщина и диаметр. На рисунке 2 приведены гистограммы распределения фазовой толщины спор. Для наиболее достоверной статистической оценки выборка составляла приблизительно 35–40 шт. на один образец.
На гистограмме (см. рис. 2, а) отражено довольно широкое распределение показателей фазовой толщины (100–200 нм), соответствующее неоднородной популяции спор, включающей молодые и зрелые образцы. Однако существует четкий максимум в районе 128 нм, показывающий что большинство (~50%) сконцентрировалось там, где фазовая толщина колеблется от 122 до 132 нм.  При воздействии на споры парами уксусной кислоты в течение 14 суток фазовая толщина спор резко снизилась с максимумом в районе 100 нм (рис. 2, б). Аналогичная ситуация наблюдалась и при обработке спор 10%-ным раствором перекиси водорода и высокой (~100°С) температурой (пар).
При воздействии на споры парами уксусной кислоты в течение 14 суток фазовая толщина спор резко снизилась с максимумом в районе 100 нм (рис. 2, б). Аналогичная ситуация наблюдалась и при обработке спор 10%-ным раствором перекиси водорода и высокой (~100°С) температурой (пар).
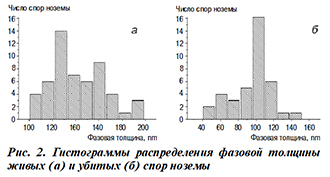
Изменения, вызванные внешними факторами, привели и к изменению поперечного диаметра d споры (продольный диаметр споры искажается в зависимости от ее ориентации в пространстве). На рисунке 3 приведены гистограммы распределения промеров диаметра живых и мертвых спор.
 Так, диаметр живых спор составлял 2,5–3,5 мкм с максимумом в районе 2,5 мкм. Под воздействием дезинфектантов и температуры этот показатель увеличивался, и максимум гистограммы сместился в область 3–4 мкм. Однако число спор с диаметром 2,5 мкм, соответствующие живым спорам, осталось достаточно большим. Это свидетельствует о том, что не все споры в силу своих физиологических особенностей изменили диаметр.
Так, диаметр живых спор составлял 2,5–3,5 мкм с максимумом в районе 2,5 мкм. Под воздействием дезинфектантов и температуры этот показатель увеличивался, и максимум гистограммы сместился в область 3–4 мкм. Однако число спор с диаметром 2,5 мкм, соответствующие живым спорам, осталось достаточно большим. Это свидетельствует о том, что не все споры в силу своих физиологических особенностей изменили диаметр.
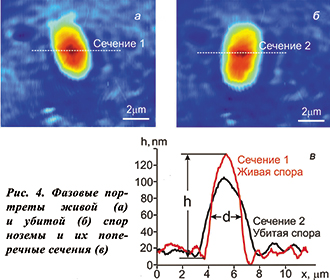
Еще один немаловажный параметр, отражающий состояние спор, — рефрактерность. Под рефрактерностью мы понимаем среднюю по объему разницу показателя преломления света спорой и окружающей ее средой. Если предположить, что в поперечном сечении спора имеет форму круга, то рефрактерность определяется как отношение фазовой толщины споры h к ее диаметру d (рис. 4).
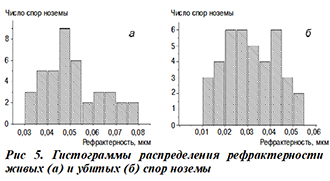 На рисунке 5 приведены гистограммы распределения рефрактерности спор.
На рисунке 5 приведены гистограммы распределения рефрактерности спор.
Мы видим, что средний показатель преломления изменился на 0,02.
При этом часть спор с рефрактерностью 0,045 не изменила этот показатель, что подтверждает многочисленные научные данные о том, что небольшая часть (не более 10%) биологических объектов не изменяется под воздействием внешних факторов.
Проведенные исследования показывают, что методы лазерной интерференционной микроскопии позволяют объективно оценивать функциональное состояние спор микроспоридий рода нозема по ряду морфометрических признаков и служить объективным критерием оценки качества дезинфекции объектов пчеловодства при нозематозе.
А.Б.СОХЛИКОВ, П.С.ИГНАТЬЕВ
ВНИИВСГЭ, ООО «Лаборатория Амфора»

Ядовитые пыльценосы пойменных фитоценозо…
июль 12, 2017
Рамки, рамки, рамки... (4)…
янв 19, 2018
Противовирусное средство — лозеваль…
июль 19, 2019
Чистопородное разведение пчел на юге Рос…
авг 13, 2014
Может ли закон обязывать должностных лиц…
апр 12, 2019
Цветок нежности и мужества…
фев 20, 2017
Домашняя воскотопка
март 19, 2016
Важнейшие биологические особенности проц…
апр 10, 2016
Ранневесенние медоносы степной зоны…
июнь 5, 2018
Микроэлементы в жизнедеятельности органи…
окт 27, 2019
Мини-нуклеус
апр 14, 2021
Наблюдения ловца роев
июль 9, 2015















 Адрес редакции журнала "Пчеловодство":
Адрес редакции журнала "Пчеловодство":