![]() Биологически активные продукты пчеловодства (БАПП) в настоящее время применяют в качестве ингредиентов биологически активных добавок (БАД). Их безопасность следует не только строго контролировать, но желательно, и прогнозировать.
Биологически активные продукты пчеловодства (БАПП) в настоящее время применяют в качестве ингредиентов биологически активных добавок (БАД). Их безопасность следует не только строго контролировать, но желательно, и прогнозировать.
Известно, что пчелиная обножка — продукт смешанного происхождения, она присутствует в составе меда и прополиса, является основой перги и представляет собой БАД. Присутствие различных поллютантов в перечисленных БАПП в большой степени определяется наличием в них пыльцы. Поэтому естественный уровень микробной обсемененности пыльцевой обножки служит отправной точкой в оценке микробиологической безопасности продуктов пчеловодства.
Существует проблема несоответствия партий обножки из различных регионов России требованиям СанПиН 2.3.2.1078—01 по микробиологическим показателям, что не всегда связано с соблюдением технологии сбора, транспортировки и хранения этого продукта. Вероятно, что это несоответствие возникает из-за состава эпифитной микрофлоры обножки.
Мы изучали эпифитную микрофлору пыльцевой обножки медоносных пчел, собранной в июне 2002, 2003, 2004 гг. на пасеках в различных природно-климатических зонах Новосибирской и Кемеровской областей, а также Алтайского края. Образцы обрабатывали с соблюдением технологических требований. Оценивали микробиологические показатели, регламентируемые СанПиН 2.3.2.1078—01, с помощью методов, установленных соответствующими ГОСТами, в лицензируемой микробиологической лаборатории СибНИПТИП СО РАСХН. Монофлерные образцы получали механическим делением полифлерных в ходе ольфакторного и палинологического анализов. Экспериментальные данные исследовали с использованием пакета прикладных программ Snedekor V4 методами вариационного, дисперсионного, корреляционного анализов, определения популяций по Животовскому.
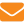
 Обножка, собранная в 2002 и 2003 гг., по общей микробной обсемененности отвечала нормативным требованиям, по загрязненности плесневыми грибами им соответствовали только 16,7% образцов (табл. 1). Большинство характеризовалось превышением норматива (не более 100 КОЕ/г) в 1,4–3,3 раза. В составе микофлоры доминировали виды родов Muсor и Penicillium. Частота встречаемости по вариантам для этих групп составляла 100%, для видов родов Sporotrichum, Aureobasidium и Stemphylium — 60, 20 и 20% соответственно.
Обножка, собранная в 2002 и 2003 гг., по общей микробной обсемененности отвечала нормативным требованиям, по загрязненности плесневыми грибами им соответствовали только 16,7% образцов (табл. 1). Большинство характеризовалось превышением норматива (не более 100 КОЕ/г) в 1,4–3,3 раза. В составе микофлоры доминировали виды родов Muсor и Penicillium. Частота встречаемости по вариантам для этих групп составляла 100%, для видов родов Sporotrichum, Aureobasidium и Stemphylium — 60, 20 и 20% соответственно.
Достоверное влияние района сбора (F>Fт) на микробную обсемененность обножки выявлено в 2003 г., когда изменения этого показателя достигли 88%. Год сбора незначительно влиял как на общую, так и на грибную микрофлору обножки (38 и 12% соответственно).
Слабая корреляция количественных показателей эпифитной микрофлоры с полифлерностью обножки (r=0,31) не позволяет судить о существенной роли ботанического происхождения в ее формировании. Прослеживалась тенденция к снижению количества микромицетов с возрастанием видового разнообразия обножек в образце (r=–0,29).
Эпифитная микофлора обножки в 2004 г. ни по количественному, ни по качественному составу не зависела от района сбора. Максимально (20%) этот фактор воздействовал на количество микромицетов, но несущественно (F<Fт). Таким образом, только в один год из трех было выявлено достоверное влияние района сбора обножки на ее общую микробную обсемененность.
Санитарно-гигиеническая оценка обножки показала, что КМАФАнМ изменялся в зависимости от районам сбора от (5,7±2,5)х102 до (2,7±0,7)х103 КОЕ/г. Это на 1–2 порядка ниже установленного стандартом уровня (1х104 КОЕ/г). Количество спор Bacillus cereus не превышало норматив (При сравнении средних показателей количества микромицетов, выделенных из обножки в 2004 г., установлено достоверное увеличение в образце из Новосибирского района по сравнению с показателями образцов из Мошковского, Залесовского и Мундыбашевского районов (P=0,99), а также из Коченевского (P=0,95).
Анализ популяций микромицетов обножки показал их количественную и качественную разнородность. Критерий идентичности при попарном сравнении колебался от 37 до 79 (c21%=23,2), а показатель общего сходства составил 1,56±0,05. Общее количество микромицетов в составе эпифитной микрофлоры обножки возрастало за счет редких видов грибов (r=0,83; P=0,95), но слабо коррелировало с их видовым разнообразием (r=–0,06).
В образцах из всех районов были представлены виды родов Penicillium и Alternaria. Частота встречаемости в составе эпифитной микрофлоры обножки видов рода Mucor составила 87,5%, Auerobasidium — 50, Aspergillus, Absidia, Trichoderma — по 25, Candida —12,5%. Всего из обножки сбора 2004 г. в среднем по районам выделено 95 штаммов микромицетов, принадлежащих к 11 родам.
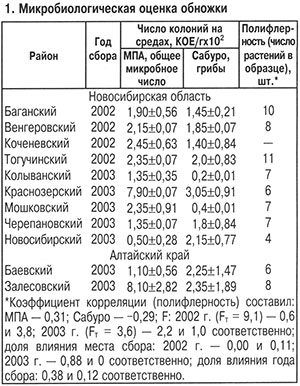
 Микологический анализ обножек разного ботанического происхождения в полифлерном образце из одного района подтвердил неодинаковое представительство микромицетов (табл. 2).
Микологический анализ обножек разного ботанического происхождения в полифлерном образце из одного района подтвердил неодинаковое представительство микромицетов (табл. 2).
Максимальное видовое разнообразие с наибольшей долей редко встречающихся видов отличало обножку бежевого цвета. Общее сходство микофлоры обножек разного ботанического происхождения было меньше (1,29±0,08), чем у полифлерной из разных районов. Это связано с тем, что видовой состав микофлоры обножек двух разных видов (желтой и ярко-желтой) был однотипным, критерий идентичности — 8,0 (c21%=18,5).
Независимо от района сбора значительная доля образцов обножки характеризовалась повышенной по сравнению с установленными требованиями обсемененностью грибной микрофлорой. Видовое разнообразие микромицетов специфично для каждого района и зависит от ботанического происхождения обножки.
Свои дальнейшие исследования мы предполагаем направить на оценку безопасности выявленных штаммов и изучение факторов формирования эпифитной микрофлоры обножки. Но уже сейчас следует признать, что разработка показателей безопасности обножки с учетом естественного уровня микробной обсемененности, на необходимость которой указывал Р.Г.Хисматуллин с соавторами (ж-л «Пчеловодство», №7, 2004), — первоочередная задача в области стандартизации этого продукта.
Л.А.ОСИНЦЕВА, К.Я.МОТОВИЛОВ, Г.П.ЧЕКРЫГА, О.В.СОЛОВЬЕВА
Новосибирский государственный аграрный университет, СибНИПТИП СО РАСХ

Соединяю слабые семьи весной…
март 23, 2019
Пчелы и лес — извечные сотрудники…
авг 15, 2014
Пчелы на гречихе
мая 12, 2017
Замена сотов
сен 21, 2014
Антидотная активность компонентов маточн…
окт 31, 2019
Разведение пчел при нерегулярном посещен…
нояб 10, 2021
Ветеринарно-санитарные мероприятия на па…
окт 5, 2017
Характерные признаки и время проявления …
окт 23, 2015
Кормовые бобы пчелам
авг 27, 2019
Мнение о существующих ульях…
сен 12, 2022
Боритесь со слабыми семьями…
нояб 1, 2020
Моя магазинная рамка
дек 3, 2015















 Адрес редакции журнала "Пчеловодство":
Адрес редакции журнала "Пчеловодство":